Δημήτριος Η. Στεφανόπουλος MD, MSc
Ενδοκρινολόγος – Διαβητολόγος
Επιστ. Συνεργάτης Ιατρικής Σχολής ΕΚΠΑ – Νοσ. ΚΑΤ
Γενικά στοιχεία περί ομόζυγου β-θαλασσαιμίας
Η ομόζυγος β-θαλασσαιμία αποτελεί μία ιδιαίτερα σοβαρή νοσολογική οντότητα του αιμοποιητικού συστήματος που μέχρι πρόσφατα ήταν επίσης γνωστή υπό τον όρο «μεσογειακή αναιμία». Οφείλει την ονομασία της στην υψηλή επίπτωση με την οποία απαντάται στις χώρες της Μεσογείου σε σύγκριση με τον υπόλοιπο κόσμο. Συχνά συναντάται επίσης στις περιοχές του Καυκάσου, στη Μέση Ανατολή, στην Ινδία και στη νοτιοανατολική Ασία (Εικόνα 1). Ο συνολικός πληθυσμός των β-θαλασσαιμικών ασθενών ανέρχεται στα 100.000 άτομα παγκοσμίως, ενώ σύμφωνα με τα πιο πρόσφατα επιδημιολογικά δεδομένα στην Ελλάδα διαβιούν σήμερα περίπου 3.000 πάσχοντες.2
Εικόνα 1. Γεωγραφική κατανομή της β-θαλασσαιμίας.
Οι περιοχές που βρίσκονται στην κόκκινη ζώνη είναι εκείνες στις οποίες η νόσος εμφανίζει την υψηλότερη επίπτωση. Πηγή: “Guidelines for the clinical management of Thalassemia”, 2nd Revised Edition 2008.2
Σε επίπεδο αιτιοπαθογένειας η ομόζυγος β-θαλασσαιμία είναι κληρονομούμενο νόσημα, με πιθανότητα εμφάνισης 25% σε κάθε κύηση όταν και οι δύο γονείς είναι φορείς της νόσου («ετεροζυγώτες», κατάσταση που παλαιότερα ήταν γνωστή ως «στίγμα»). Τα πάσχοντα τέκνα εμφανίζουν βλάβη των γονιδίων που είναι υπεύθυνα για την παραγωγή των β-αλυσίδων της αιμοσφαιρίνης, οι οποίες και παράγονται σε πολύ μικρό βαθμό (ενδιάμεση μορφή β-θαλασσαιμίας) ή καθόλου (μείζων μορφή).1
Χωρίς β-αλύσους δεν μπορεί να παραχθεί φυσιολογική αιμοσφαιρίνη (HbA), με αποτέλεσμα τα ερυθρά αιμοσφαίρια να καταστρέφονται εύκολα και να προκύπτει βαρύτατη αναιμία, πλημμελής οξυγόνωση των ιστών και συνοδός αύξηση του μεγέθους του ήπατος και του σπληνός. Θεραπευτικά απαιτούνται συχνές μεταγγίσεις αίματος, οι οποίες όμως οδηγούν σε επιβλαβή εναπόθεση μεγάλων ποσοτήτων σιδήρου που καθιστάται τοξικός για τα όργανα των πασχόντων. Η κατάσταση αυτή καλείται «αιμοσιδήρωση» και εφόσον δεν αντιμετωπιστεί επιτυχώς από πολύ μικρή ηλικία με την εφαρμογή ειδικής αγωγής αποσιδήρωσης, προκαλεί σοβαρές έως και θανατηφόρες επιπλοκές. Ενδεικτικά αναφέρονται οι διαταραχές από τους ενδοκρινείς αδένες, η σχεδόν πάντοτε παρούσα οστική νόσος (Πίνακας 1), οι συχνά σοβαρές καρδιαγγειακές εκδηλώσεις και η χρόνια ηπατοπάθεια.
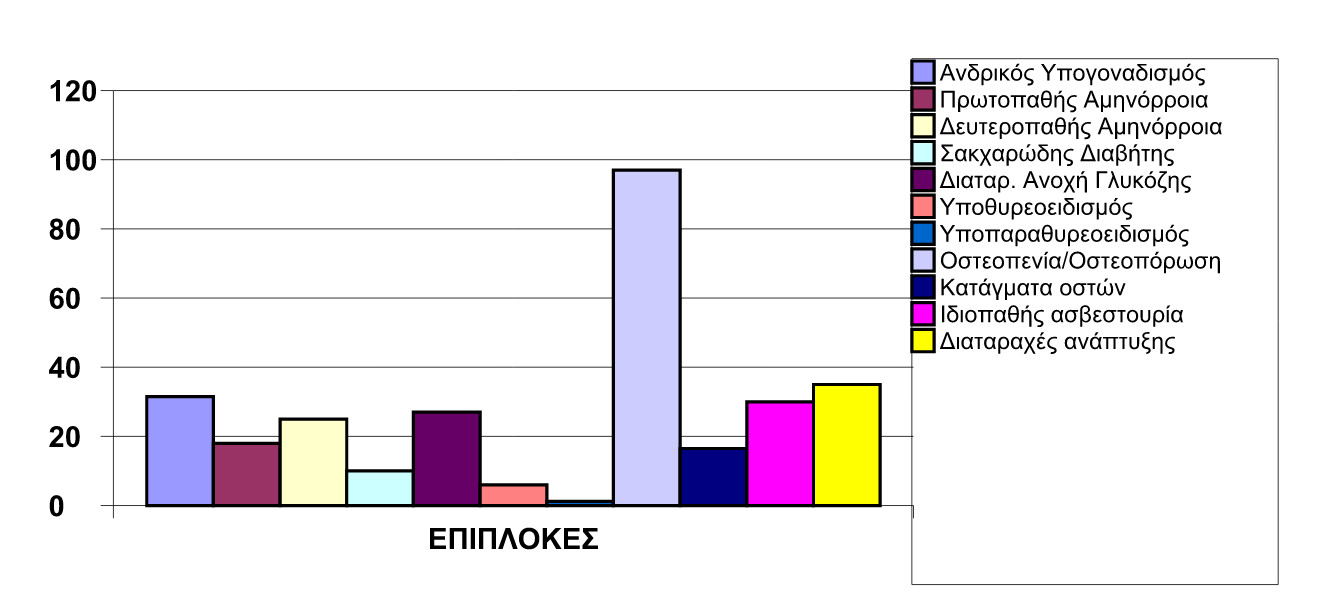
Πίνακας 1: Συχνότητα (%) ενδοκρινικών επιπλοκών και μεταβολικών διαταραχών σε ασθενείς με ομόζυγο β-θαλασσαιμία.
Πηγή: Τροποποίηση με προσαρμογή στα σύγχρονα ελληνικά δεδομένα, από “Multicentre study on endocrine complications in thalassemia major”, De Sanctis et al., Clin Endocrinol 1995 42:581-86.
Ορισμός και Επιδημιολογία της οστικής νόσου στη β-θαλασσαιμία
Από πολλά έτη οι επιστήμονες είχαν παρατηρήσει ότι μία από τις συνηθέστερες επιπλοκές στην ομόζυγο β-θαλασσαιμία είναι η μείωση της μάζας και της αντοχής των οστών, με άμεσο επακόλουθο την αύξηση της συχνότητας πρόκλησης καταγμάτων.3,4 Η κατάσταση αυτή – που ανάλογα με τη βαρύτητά της περιγράφεται ως οστεοπενία ή οστεοπόρωση – παρατηρείται σήμερα στο 40-50% των ικανοποιητικά θεραπευόμενων ενηλίκων θαλασσαιμικών, ανεξαρτήτως φύλου, ενώ το ποσοστό αυτό ξεπερνά ακόμη και το 90% στα μεγαλύτερα σε ηλικία ή/και ανεπαρκώς θεραπευόμενα άτομα (Πίνακας 1). Οι σπόνδυλοι είναι τα οστά που πλήττονται συχνότερα, ακολουθεί το περιφερικό άκρο του αντιβραχίου και τέλος η περιοχή του ισχίου.5-8
Οι διαταραχές όμως που αναπτύσσονται στο σκελετό των β-θαλασσαιμικών ασθενών δεν έχουν να κάνουν απλώς με την πρώιμη εμφάνιση οστεοπόρωσης. Στην πλειοψηφία των περιστατικών συνυπάρχουν και άλλες σοβαρές αλλοιώσεις όπως είναι η ανεπαρκής επιμετάλλωση, οι παραμορφώσεις και οι διαταραχές της φυσιολογικής ανάπτυξης των οστών. Για το λόγο αυτό, ο όρος «οστική νόσος της β-θαλασσαιμίας» έχει υιοθετηθεί πλέον από τους περισσότερους συγγραφείς, με σκοπό να περιγράψει το σύνολο των προαναφερθέντων προβλημάτων.5-8
Αίτια και μηχανισμοί ανάπτυξης της οστικής νόσου στη β-θαλασσαιμία
Ι. Η επέκταση του ερυθροποιητικού μυελού:
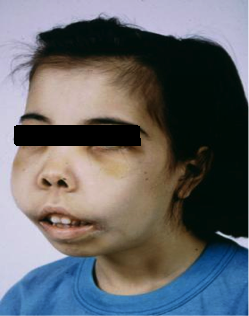
Όπως είναι ευρύτερα γνωστό τα οστά περιέχουν σε άλλοτε άλλο βαθμό ερυθροποιητικό μυελό, ο οποίος αποτελεί το βασικό ιστό παραγωγής των ερυθρών αιμοσφαιρίων του αίματος. Στους πάσχοντες από ομόζυγο β-θαλασσαιμία ο μυελός των οστών διατηρεί την ικανότητα παραγωγής ερυθροκυττάρων, μολονότι στη συνέχεια αυτά καταστρέφονται. Όταν λοιπόν εγκαθίστανται οι συνθήκες βαριάς αναιμίας και ανεπαρκούς οξυγόνωσης που χαρακτηρίζουν τη νόσο, ο οργανισμός αντιδρά εκπτύσσοντας υπέρμετρα το μυελό. Η υπερβολική αυτή διόγκωση ευθύνεται για σταδιακή ανάπτυξη σοβαρών οστικών παραμορφώσεων και αλλοιώσεων (Εικόνα 2). Eυτυχώς στη σημερινή εποχή με τα σύγχρονα πρωτόκολλα θεραπείας ο μυελός καταστέλλεται ικανοποιητικά, με αποτέλεσμα να εκλείπουν πλέον οι έντονες οστικές παραμορφώσεις. Εντούτοις ένας μικρός βαθμός αυξημένης δραστηριότητας συνεχίζει να υπάρχει, προκαλώντας με τα χρόνια διαταραχές της μικροαρχιτεκτονικής και της αντοχής των οστών. 4,8
Εικόνα 2: Εκσεσημασμένες οστικές αλλοιώσεις σε ασθενή με ομόζυγο β-θαλασσαιμία.
Πηγή: Hassan M Yaish MD., University of Utah School of Medicine, Department of Pediatrics, Primary Children’s Medical Center.
ΙΙ. Ο ρόλος της αιμοσιδήρωσης και των φαρμάκων αποσιδήρωσης:
Η υπερβολική συγκέντρωση κυτταροτοξικού σιδήρου στα οστά εξαιτίας των πολλαπλών μεταγγίσεων καταστρέφει τα οστεοπαραγωγικά κύτταρα (οστεοβλάστες), διεγείρει τον πολλαπλασιασμό και τη δράση των κυττάρων που καταστρέφουν το οστό (οστεοκλάστες), ενώ παραβλάπτει και τη διαδικασία εμπλουτισμού του οστού σε μέταλλα όπως το ασβέστιο (επιμετάλλωση).4,9 Από την άλλη, οι φαρμακευτικοί παράγοντες που προστατεύουν από την αιμοσιδήρωση είναι δυνατό να επηρεάσουν και αυτοί αρνητικά τον οστικό μεταβολισμό, ιδίως όταν χορηγούνται για μακρά διαστήματα σε υπερβολικά υψηλές δόσεις. Στις περιπτώσεις αυτές, πέρα από τη διαταραχή της φυσιολογικής λειτουργίας οστεοβλαστών και οστεοκλαστών, είναι δυνατό να ανασταλεί ο σχηματισμός του κολλαγόνου (βασικό θεμέλιο συστατικό του οστού) και να προκληθεί ανεπάρκεια προστατευτικών για το σκελετό μετάλλων και ιχνοστοιχείων όπως είναι ο ψευδάργυρος και οι βιταμίνες D και C.
ΙΙΙ. Διαταραχές κυτταροκινών και αυξητικών παραγόντων:
Οι κυτταροκίνες και οι αυξητικοί παράγοντες είναι πρωτεΐνες που με τη δράση τους ρυθμίζουν τη λειτουργία πολλών κυττάρων και ιστών στο ανθρώπινο σώμα. Στην ομόζυγο β-θαλασσαιμία έχουν διαπιστωθεί διαταραχές σε αρκετά από τα πρωτεϊνικά αυτά συστήματα που επιδρούν δυσμενώς στο μεταβολισμό των οστών. Ενδεικτικά αναφέρονται οι υπέρμετρες αυξήσεις των επιπέδων του παράγοντα RANKL, των ιντερλευκινών IL-1 και IL-6 και των παραγόντων TNFα και Dickkopf-1 (Dkk-1), οι οποίες προάγουν τον πολλαπλασιασμό και τη δράση των οστεοκλαστών (αυξάνοντας την καταστροφή του οστού) και αναστέλλουν τη διαφοροποίηση και τη λειτουργία των οστεοβλαστών (ελαττώνοντας την οστική παραγωγή). Αιτιολογικά για την εμφάνιση των ανωτέρω έχουν ενοχοποιηθεί κυρίως η σοβαρή αιμοσιδήρωση, τα φάρμακα αποσιδήρωσης, οι ενδοκρινικές επιπλοκές (βλ. παρακάτω) και η ηπατική συννοσηρότητα που επιπλέκουν τη β-θαλασσαιμία.3,4,13-15
_____________________________________________________________________
RANK: Υποδοχέας που ενεργοποιεί τον πυρηνικό παράγοντα κΒ, RANKL: Συνδέτης του υποδοχέα που ενεργοποιεί τον πυρηνικό παράγοντα κΒ, OPG: Οστεοπροτεγερίνη, TNFa: Παράγοντας νέκρωσης όγκων α.
IV. Ενδοκρινικές επιπλοκές:
Το πλεονάζον φορτίο κυτταροτοξικού σιδήρου και δευτερευόντως η ηπατική δυσπραγία και η προβληματική απορρόφηση μετάλλων και βιταμινών από το γαστρεντερικό σωλήνα, ευθύνονται για την ανάπτυξη πλήθους ενδοκρινικών επιπλοκών που επιδεινώνουν περαιτέρω τον ήδη διαταραγμένο οστικό μεταβολισμό στους β-θαλασσαιμικούς αρρώστους. Οι κυριότερες από τις διαταραχές αυτές παρατίθενται στη συνέχεια και οδηγούν σε διαταραχές της πυκνότητας, της αρχιτεκτονικής, της ανάπτυξης και της μετάλλωσης των οστών.
(α) Υπογοναδισμός: Αφορά σε προβληματική λειτουργία του αδένα της υπόφυσης ή/και των κυττάρων των γονάδων (όρχεις και ωοθήκες), η οποία απαντάται στο 40-70% των β-θαλασσαιμικών, ισότιμα και στα δύο φύλα. Το αποτέλεσμα είναι η ανάπτυξη σοβαρής ανεπάρκειας των στεροειδών ορμονών του φύλου (ανδρογόνων και οιστρογόνων) και κατ’επέκταση η απώλεια των πολλαπλών ευεργετικών επιδράσεων που αυτές ασκούν στο σκελετό.3,4
(β) Διαταραχή του άξονα GH/IGF1: Παθολογικά χαμηλά επίπεδα αυξητικής ορμόνης (GH) και ινσουλινόμορφου αυξητικού παράγοντα (IGF1) διαπιστώνονται σε ποσοστό 3-15% επί των συνόλου των πασχόντων.25-32
(γ) Σακχαρώδης Διαβήτης (ΣΔ): Η συγκεκριμένη επιπλοκή αναπτύσσεται μέχρι και στο 11% των ατόμων με ομόζυγο β-θαλασσιαμία.4, 33-35
(δ) Υποθυρεοειδισμός: Ανεπαρκής έκκριση θυρεοειδικών ορμονών απαντάται στο 10-15% των αρρώστων. Διαταράσσει το μεταβολισμό του ασβεστίου, ενώ ταυτόχρονα μπορεί να επιδεινώσει τυχόν συνυπάρχοντα υπογοναδισμό ή να ευοδώσει την εκδήλωσή του.
(ε) Υποπαραθυρεοειδισμός: Αφορά σε σημαντική ελάττωση των επιπέδων της παραθορμόνης (ΡΤΗ) στο αίμα και εκδηλώνεται στο 4-6% των ασθενών. Η ελλιπής δράση αυτής της ορμόνης οδηγεί σε σοβαρή υπασβεστιαιμία, υπερασβεστιουρία και μειωμένη δράση της βιταμίνης D.
(στ) Λοιπές μεταβολικές επιπλοκές:
-
Ανεπάρκεια βιταμινών: Σε έδαφος β-θαλασσαιμίας διαπιστώνονται συχνά τόσο ανεπάρκεια της βιταμίνης D όσο και έλλειψη της βιταμίνης C.4,9,10
-
Διαταραγμένη ομοιοστασία μετάλλων: Σε πολλές ξεχωριστές πηγές αναφέρεται ότι στο 30% των β-θαλασσαιμικών ασθενών αναπτύσσεται υπερβολική απέκκριση ασβεστίου στα ούρα που συχνά επιπλέκεται με νεφρολιθίαση. Επιπρόσθετα προβλήματα που ταλαιπωρούν το συγκεκριμένο πληθυσμό αποτελούν η υπασβεστιαιμία (απότοκος του υποπαραθυρεοειδισμού που περιγράφηκε παραπάνω), καθώς και η ανεπάρκεια μετάλλων με προστατευτικές επιδράσεις στο σκελετό όπως είναι ο ψευδάργυρος και ο χαλκός.4,36,37
V. Γενετικά και περιβαλλοντικά αίτια
Πέρα όλων όσων έχουν αναφερθεί μέχρι στιγμής, τονίζεται ότι ορισμένοι β-θαλασσαιμικοί ασθενείς εμφανίζουν αυξημένη γενετική προδιάθεση για ανάπτυξη σοβαρής οστικής νόσου, λόγω παρουσίας κληρονομήσιμων ή επίκτητων γονιδιακών βλαβών που διαταράσσουν τη λειτουργία και τη δομή των οστών. Διαταραχές του κολλαγόνου, προβληματική λειτουργία της βιταμίνης D, των οιστρογόνων και άλλων ορμονών, αποτελούν ορισμένες μόνο από τις εκδηλώσεις των γενετικών αυτών ανωμαλιών.3,4,38,39
Τέλος – όπως ισχύει και για το γενικό πληθυσμό – η αρνητική επίδραση ορισμένων περιβαλλοντικών παραγόντων και συνηθειών ζωής μπορεί να διαταράξει περαιτέρω τη λειτουργία των οστών στους πάσχοντες. Χαρακτηριστικά παραδείγματα αποτελούν η ελαττωμένη φυσική δραστηριότητα, η μειωμένη έκθεση στον ήλιο, η κακή διατροφή, η ανεπαρκής λήψη γαλακτοκομικών, το κάπνισμα και η υπερβολική κατανάλωση καφεΐνης.7,40
Κλινική εικόνα
Οι ιδιαίτεροι παράγοντες που επιδρούν αρνητικά από πολύ μικρή ηλικία στο σκελετό των ασθενών με β-θαλασσαιμία προκαλούν την πρώιμη εμφάνιση έντονων διαταραχών του μεταβολισμού και της μορφολογίας των οστών, οι οποίες αναλύονται αμέσως παρακάτω:38-42,45
(α) Καθυστέρηση της σωματικής ανάπτυξης. Οφείλεται στις ενδοκρινικές επιπλοκές που προαναφέρθηκαν, σε συνδυασμό με πιθανές αρνητικές επιδράσεις των φαρμάκων αποσιδήρωσης.
(β) Παραμορφώσεις των οστών του κρανίου. Οι αλλοιώσεις αυτές έχουν να κάνουν με ανάπτυξη «μογγολοειδούς» προσωπείου με προέχοντα ζυγωματικά, διόγκωση της άνω γνάθου, εισοχή της βάσης της ρινός και λοξές βλεφαρικές σχισμές (Εικόνα 2). Χαρακτηρίζουν την ανεπαρκώς αντιμετωπιζόμενη αιματολογική νόσο και κατά συνέπεια σπάνια απαντώνται στις μέρες μας.
(γ) Αλλοιώσεις της σπονδυλικής στήλης. Αυτές είναι αρκετά συχνές και αφορούν σε αμφίκοιλη παραμόρφωση ή επιπέδωση σπονδύλων, εκφύλιση των μεσοσπονδυλίων δίσκων, παρουσία σκολίωσης, κύφωσης και σπονδυλικών καταγμάτων.
(δ) Οστεοπενία/Οστεοπόρωση. Πρόκειται συνήθως για σοβαρή, γενικευμένη βλάβη σε ολόκληρο το σκελετό, που οδηγεί σε αυξημένη συχνότητα καταγμάτων.
(ε) Ήπιες αρθραλγίες, που οφείλονται στις επιδράσεις της αιμοσιδήρωσης, της υπερουριχαιμίας και των φαρμάκων αποσιδήρωσης στους αρθρικούς ιστούς.41,42
Διαγνωστική προσέγγιση της οστικής νόσου στη β-θαλασσαιμία
I. Απλές ακτινογραφίες: Παρέχουν πολύτιμες πληροφορίες (Εικόνα 3) και ως εκ τούτου θα πρέπει να αποτελούν αναπόσπαστο κομμάτι του απεικονιστικού ελέγχου κάθε πάσχοντα.43-45
Εικόνα 3: Χαρακτηριστικά ευρήματα σε ακτινολογικό έλεγχο πασχόντων από ομόζυγο β-θαλασσαιμία: (Ι). Οστεοπενία μακρών οστών με αδρή απεικόνιση του συστήματος των οστεοδοκίδων, λέπτυνση του φλοιού, αλλοιώσεις ραχίτιδας με κύρτωση των οστών του αντιβραχίου, αμφίκυρτη διόγκωση δακτυλικών φαλάγγων, αύξηση των μυελικών κοιλοτήτων και διεύρυνση των μεσοδοκιδωδών διαστημάτων από την επέκταση του ερυθροποιητικού μυελού. (ΙΙ). Τυπική πάχυνση/διεύρυνση του θόλου του κρανίου, «ψυκτροειδής παρυφή», υπερπλασία των οστών του προσωπικού κρανίου, εξάλειψη παραρρινίων κόλπων και ελαττωμένη πνευμάτωση των μαστοειδών αποφύσεων. Παρουσία οστεοπενίας με έντονη απεικόνιση του φλοιού και αρχόμενες παραμορφώσεις του σχήματος των σπονδύλων.
Πηγή: “The Imaging of Tropical Diseases: With Epidemiological, Pathological and Clinical Correlation.” P.E.S.Palmer, M.M.Reeder, 2nd Edition, 2001, British Institute of Radiology – Αρχείο A.Chandrahasan Johnson., Tulsa, Oklahoma.43
II. Εκτίμηση της οστικής πυκνότητας
Η εκτίμηση της οστικής πυκνότητας των β-θαλασσαιμικών πρέπει να ξεκινά περίπου κατά την ενηλικίωση και να επαναλαμβάνεται τουλάχιστον κάθε 2 έτη ή συχνότερα, αναλόγως περιστατικού. Η απορροφησιομετρία με διπλή ενεργειακή δέσμη φωτονίων-Χ (DXA) είναι η μέθοδος που χρησιμοποιείται συνήθως για το σκοπό αυτό, θα πρέπει όμως να διευκρινιστεί ότι, ειδικά στο συγκεκριμένο πληθυσμό πασχόντων, τα αποτελέσματα που παρέχει δεν εκτιμούν με ακρίβεια τις οστικές βλάβες οι οποίες κατά κανόνα υπερεκτιμώνται λόγω πολλαπλών ιδιαιτεροτήτων της αιμοσφαιρινοπάθειας. Έτσι, η συγκεκριμένη εξέταση δε χρησιμεύει τόσο για τη διάγνωση της οστικής νόσου, αποτελεί όμως ένα αξιόλογο εργαλείο παρακολούθησης της κατάστασης των οστών και αξιολόγησης των εκάστοτε θεραπευτικών παρεμβάσεων.46,47
Σε αντίθεση με τη DXA, άλλες πιο εξελιγμένες τεχνικές αξιολόγησης της οστικής πυκνότητας και της οστικής αντοχής – όπως είναι η περιφερική ποσοτική υπολογιστική τομογραφία (pQCT) – παρέχουν πολύ πιο αξιόπιστα και ακριβή αποτελέσματα αναφορικά με την εκτίμηση της σοβαρότητας της οστικής νόσου στη β-θαλασσαιμία. Εντούτοις, οι συγκεκριμένες μέθοδοι δεν μπορούν να βρουν ευρεία εφαρμογή, αφενός μεν λόγω της περιορισμένης τους διαθεσιμότητας, αφετέρου δε εξαιτίας του υψηλού κόστους και της υψηλότερης ακτινοβολίας που εκπέμπουν. 8,47-49
ΙΙΙ. Εργαστηριακός έλεγχος
Κάθε β-θαλασσαιμικός ασθενής με ήπια ή σοβαρά προβλήματα από το ερειστικό σύστημα επιβάλλεται να παρακολουθείται εργαστηριακά τουλάχιστον κάθε 6 έως 12 μήνες. Ο συγκεκριμένος έλεγχος – που διενεργείται με σκοπό την πρόληψη, τη διάγνωση και την παρακολούθηση των σκελετικών βλαβών – οφείλει να είναι απόλυτα προσαρμοσμένος στα ιδιαίτερα δεδομένα της αιματολογικής νόσου και να περιλαμβάνει.3,4,50
-
Προσδιορισμό στο αίμα των βασικών μετάλλων, βιταμινών και ιχνοστοιχείων που επηρεάζουν τον οστικό μεταβολισμό.
-
Αξιολόγηση του μεταβολισμού της γλυκόζης, της ηπατικής και της νεφρικής λειτουργίας.
-
Ειδικές ορμονολογικές εξετάσεις για την πρώιμη ανίχνευση και την αξιολόγηση του χειρισμού των ενδοκρινικών επιπλοκών της νόσου (Πίνακας 1).
-
Συλλογή ούρων 24ώρου για προσδιορισμό των επιπέδων ασβεστίου, κρεατινίνης και λευκωμάτων σε αυτά.
-
Έλεγχο της φερριτίνης αίματος, η οποία αποτελεί έναν αδρό, αλλά εύκολο και φθηνό τρόπο εκτίμησης του βαθμού αιμοσιδήρωσης.
Πρόληψη
Η οστική νόσος που αναπτύσσεται σε έδαφος ομόζυγου β-θαλασσαιμίας εμφανίζει πολυπαραγοντική αιτιολογία και διαφοροποιείται σε πολλά σημεία από την κλασική οστεοπόρωση. Ένα από αυτά είναι η εντυπωσιακή ανταπόκριση των ασθενών σε βασικές προληπτικές παρεμβάσεις που έχουν να κάνουν (α) με υιοθέτηση απλών υγιεινοδιαιτητικών συνηθειών και (β) με προσεκτική θεραπεία της αιματολογικής νόσου και των εξωσκελετικών επιπλοκών αυτής.
Στην πρώτη περίπτωση περιλαμβάνονται η επαρκής πρόσληψη γαλακτοκομικών, ο περιορισμός του άλατος και της υπερβολικής κατανάλωσης λευκωμάτων, καφεΐνης, τσαγιού και αναψυκτικών που επιτείνουν την υπερασβεστιουρία, η χαμηλή κατανάλωση αλκοόλ, η διακοπή του καπνίσματος και η κατάλληλη σωματική άσκηση.13,50-53 Σε επίπεδο αντιμετώπισης της β-θαλασσαιμίας μεγάλη σημασία έχουν η καταστολή της ενεργότητας του ερυθροποιητικού μυελού με τη βοήθεια συχνών μεταγγίσεων, η εξατομίκευση της αγωγής αποσιδήρωσης έτσι ώστε να επιλέγεται το πλέον κατάλληλο σχήμα για κάθε ασθενή και η έγκαιρη διάγνωση και αντιμετώπιση κάθε πιθανής ενδοκρινικής, ηπατικής και νεφρολογικής συννοσηρότητας.3,4
Φαρμακευτική παρέμβαση
Με τη βοήθεια των ως άνω προληπτικών μέτρων τα προβλήματα από το σκελετό των β-θαλασσαιμικών πασχόντων μπορεί να καθυστερήσουν σημαντικά ή να εκδηλωθούν με πιο ήπια κλινική εικόνα. Εντούτοις, σε πολλές περιπτώσεις οι οστικές βλάβες είναι ιδιαίτερα σοβαρές και χρήζουν ειδικής φαρμακευτικής παρέμβασης, η οποία περιγράφεται αμέσως παρακάτω.
Α. Βιταμίνη D, Ιχνοστοιχεία και Ασβέστιο:
Σε πολλούς πάσχοντες από β-θαλασσαιμία διαπιστώνεται συχνά σοβαρή ανεπάρκεια της βιταμίνης D, για τη διόρθωση της οποίας απαιτείται εξωγενής χορήγησή της, συνήθως από το στόμα. Τονίζεται όμως ότι στο συγκεκριμένο πληθυσμό αυτό πρέπει να γίνεται με προσοχή, λόγω πιθανής συνύπαρξης παθολογικών καταστάσεων – όπως ο υποπαραθυρεοειδισμός και η υπερασβεστιουρία – που επηρεάζουν (ή επηρεάζονται από) το είδος και τη δόση του σκευάσματος που τελικά επιλέγεται.3,4,50
Παράλληλα με την αναπλήρωση της βιταμίνης D οι ασθενείς οφείλουν να λαμβάνουν επαρκείς ποσότητες ασβεστίου, κυρίως με τις τροφές ή – όταν αυτό δεν είναι εφικτό – σε 2-3 διηρημένες φαρμακευτικές δόσεις στο 24ωρο για καλύτερη απορρόφηση. Επιπρόσθετα, επί παρουσίας υπερασβεστιουρίας απαιτείται ο περιορισμός αυτής, κατ’αρχάς με την υιοθέτηση των διατροφικών συνηθειών που ήδη περιγράφηκαν και εφόσον αυτές δεν καταστούν αποτελεσματικές, με τη χορήγηση θειαζιδικών διουρητικών σε χαμηλές δόσεις.3,4 Τέλος, θα πρέπει πάντοτε να διασφαλίζονται τα φυσιολογικά επίπεδα μαγνησίου, ψευδαργύρου και βιταμίνης C.51,52
Β. Διφωσφονικά:
Τα διφωσφονικά είναι μία ομάδα φαρμάκων που ελαττώνουν την υπέρμετρη καταστροφή (απορρόφηση) οστού, η οποία οδηγεί σε μείωση της οστικής μάζας και σε ανάπτυξη οστεοπόρωσης. Είναι σκευάσματα που χορηγούνται από πολλά έτη στους θαλασσαιμικούς πάσχοντες και ως εκ τούτου η χρήση τους έχει μελετηθεί αρκετά ικανοποιητικά μέχρι σήμερα στη συγκεκριμένη ομάδα του πληθυσμού. Σε γενικές γραμμές έχει φανεί ότι δεν είναι όλα τα φάρμακα αυτής της κατηγορίας το ίδιο αποτελεσματικά στην οστική νόσο της β-θαλασσαιμίας. Πολλοί κλινικοί θεωρούν ως τις πλέον αποτελεσματικές μορφές τα ενδοφλεβίως χορηγούμενα αμινο-διφωσφονικά ζολεδρονικό οξύ και παμιδρονάτη, ενώ άλλοι εμμένουν σε πιο συντηρητικά σχήματα με από του στόματος χορήγηση αλενδρονάτης ή ριζεδρονάτης.2-4,13
Η ανταπόκριση των θαλασσαιμικών οστών είναι γενικά ικανοποιητική στις ως άνω θεραπείες, καθώς αναφέρονται αυξήσεις οστικής πυκνότητας (BMD) έως και κατά 50% στη σπονδυλική στήλη και έως 40% στην περιοχή του ισχίου.54-60 Εντούτοις, η πολυπαραγοντική αιτιοπαθογένεια και οι ιδιαιτερότητες της οστικής νόσου στη μεσογειακή αναιμία, αλλά και ο συνήθως περιορισμένος αριθμός και η μεγάλη ετερογένεια των πασχόντων που συμμετείχαν στις σχετικές μελέτες, υποδεικνύουν ότι η χρήση των διφωσφονικών δε θα πρέπει να γενικεύεται αλόγιστα, αλλά να εφαρμόζεται εξατομικευμένα και μόνο στους πάσχοντες που υπάρχει σοβαρή πιθανότητα να ωφεληθούν από αυτήν.
Γ. Denosumab:
Το Denosumab ασκεί την αντιοστεοπορωτική του δράση όπως τα διφωσφονικά, ελαττώνοντας δηλαδή την απορρόφηση οστού. Εντούτοις, αυτό το κατορθώνει μέσω ενός εντελώς διαφορετικού μηχανισμού δράσης, πολύ πιο συμβατού με την παθοφυσιολογία της οστικής νόσου στη β-θαλασσαιμία, γεγονός που το καθιστά πιθανότατα αρκετά πιο αποτελεσματικό ως φάρμακο. Πράγματι, στην πρώτη σχετική μελέτη που είδε το φως της δημοσιότητας μέσα στο 2013, οι M.Yassin και συν. παρουσίασαν εντυπωσιακές αυξήσεις στην οστική μάζα της σπονδυλικής στήλης και του ισχίου 30 νέων θαλασσαιμικών ασθενών με σοβαρή οστική νόσο, ένα έτος μετά τη χορήγηση Denosumab στην κλασική δόση των 60mg/εξάμηνο.65 Σημειώνεται δε ότι αρκετές ακόμη νέες σχετικές μελέτες βρίσκονται σε εξέλιξη, τα αποτελέσματα των οποίων αναμένεται με ενδιαφέρον να ανακοινωθούν σύντομα.
Δ. Λοιπά αντιοστεοπορωτικά φάρμακα:
Πέρα από τα σκευάσματα που βελτιώνουν την οστική πυκνότητα ελαττώνοντας την απορρόφηση οστού, υπάρχουν και εκείνα που δρουν μέσω αύξησης της οστικής παραγωγής. Τον κύριο εκπρόσωπο αυτής της κατηγορίας αποτελεί η τεριπαρατίδη, ή οποία μολονότι επιτυγχάνει εξαιρετικά αποτελέσματα στο γενικό πληθυσμό, μέχρι σήμερα δεν έχουν δημοσιευθεί κλινικές μελέτες για τη χρήση της στην ομόζυγο β-θαλασσαιμία. Κατά συνέπεια – και από τη στιγμή που κανένα φάρμακο δεν είναι άμοιρο ανεπιθύμητων ενεργειών – οφείλουμε να είμαστε πολύ προσεκτικοί στην εφαρμογή της τεριπαρατίδης στους συγκεκριμένους ασθενείς με την πολυποίκιλη μεταβολική, καρδιαγγειακή και ηπατική συννοσηρότητα,.57,64 Όσον αφορά τέλος στο ρανελικό στρόντιο, επισημαίνεται ότι θα πρέπει μάλλον να αποφεύγεται η χορήγησή του στη β-θαλασσαιμία, κυρίως λόγω της αυξημένης πιθανότητας για επιδείνωση καρδιαγγειακών επιπλοκών.
Συμπεράσματα
Η ομόζυγος β-θαλασσαιμία συνοδεύεται σχεδόν πάντοτε από μία σοβαρή μορφή οστικής νόσου πολυπαραγοντικής αιτιοπαθογένειας, η οποία αναπτύσσεται από μικρή ηλικία, εμφανίζει πολλές ιδιαιτερότητες και επηρεάζεται από πλήθος παραγόντων που σχετίζονται με τα δεδομένα, τη συννοσηρότητα και τη θεραπεία της αιματολογικής νόσου. Η τακτική κλινική παρακολούθηση σε συνδυασμό με τον εξειδικευμένο εργαστηριακό και απεικονιστικό έλεγχο των πασχόντων θέτουν τη διάγνωση των οστικών επιπλοκών, προσδιορίζουν τη βαρύτητά τους και καθορίζουν τα πλαίσια στα οποία πρέπει να κινηθεί το θεραπευτικό μας πλάνο. Η ενημέρωση των ασθενών και η καθολική εφαρμογή των υγιεινοδιαιτητικών μέτρων που προαναφέρθηκαν πρέπει να αποτελούν τον πρωταρχικό στόχο κάθε ομάδας κλινικών ιατρών που ασχολούνται με τη β-θαλασσαιμία. Επιπρόσθετα, η σωστή θεραπεία της αιματολογικής νόσου, η έγκαιρη και αποτελεσματική καταπολέμηση της όποιας συννοσηρότητας και η εξατομικευμένη προσέγγιση κάθε ασθενούς με σκοπό την επιλογή της κατάλληλης ειδικής αντιοστεοπορωτικής αγωγής, αποτελούν τις βασικές προϋποθέσεις για την κατά το δυνατόν αποτελεσματικότερη αντιμετώπιση των ιδιαίτερων σκελετικών προβλημάτων των πασχόντων.
_____________________________________________________________________
Βιβλιογραφία
1. N.F. Olivieri. “The β-Thalassemias.” N Engl J Med 1999; 341:99-109.
- National Thalassemia Federation – “Guidelines for the clinical management of Thalassemia”, 2nd Revised Edition 2008, by M.D.Cappellini, A.Cohen et al.
- M.Toumba and Nicos Skordis. “Osteoporosis Syndrome in Thalassaemia Major: An Overview.” Journal of Osteoporosis Volume 2010, 7 pages.
- E.Terpos and E.Voskaridou “Treatment options for thalassemia patients with osteoporosis.”, Ann. N.Y. Acad. 2010, p:237–243.
- R.Origa, E.Fiumana et al., “Osteoporosis in β-Thalassemia: Clinical and Genetic Aspects.” Annals of the New York Academy of Sciences, Volume 1054, Issue 1, November 2005, Pages: 451–456.
- A. Christoforidis, E. Hatzipantelis et al., “Bone mineral density in children and young adults with β-thalassemia major conventionally treated,” Pediatric Blood and Cancer, vol. 47, no. 1, pp. 113–114, 2006.
- Kyriakou A., Savva SC. et al. “Gender differences in the prevalence and severity of bone disease in thalassaemia.” Pediatric Endocrinology Reviews. 2008;6 (supplement 1) :116–122.
- Ladis V., Raptou P. et al., “Study of bone density by pQCT analysis in healthy adults and patients with B-thalassemia major and intermedia.” Pediatr Endocrinol Rev. 2008 Oct;6 Suppl 1:127-31.
- P.Mahachoklertwattana, V.Sirikulchayanonta et al., “Bone Histomorphometry in Children and Adolescents with β-Thalassemia Disease: Iron-Associated Focal Osteomalacia.” 88 (8): 3966-3972.
- S.De Virgiliis, M.Congia et al., “Deferoxamine-induced growth retardation in patients with thalassemia major.” Journal of Pediatrics, vol.113, no.4, 1988, pp. 661–669.
- Sundeep Khosla, “Minireview: The OPG/RANKL/RANK system”, Endocrinology, December 2001, 142 (12):5050-5055.
- B.F.Boyce, L.Xing. “Functions of RANKL/RANK/OPG in bone modeling and Remodeling.” Arch Biochem Biophys. 2008 May 15;473 (2):139–146.
- E.Voskaridou and E.Terpos. “New insights into the pathophysiology and management of osteoporosis in patients with β thalassaemia.” British Journal of Haematology, 2004, vol. 127, no.2, pp. 127–139.
- N.Morabito, A.Gaudio et al., “Osteoprotegerin and RANKL in the pathogenesis of thalassemia-induced osteoporosis: new pieces of the puzzle,” Journal of Bone and Mineral Research, vol. 19, no. 5, 2004, pp. 722–727.
- Morabito N., Russo GT. et al., “The “lively” cytokines network in β-thalassemia major-related osteoporosis.” Bone. 2007; 40(6):1588–1594.
- B.Lawrence Riggs, S.Khosla et al., “Sex Steroids and the construction and conservation of the adult skeleton.” Endocrine Reviews 23(3):279–302.
- Juliet E.Compston “Sex Steroids and Bone.” Physiological Reviews, Vol.81, No. 1, January 2001.
- Cl.Ribot, Fl.Trémollieres et al., “Aromatase and regulation of bone remodelling”
Joint Bone Spine 73 (2006) 37–42.
- Baruch Frenkel, Albert Hong et al., “Regulation of Adult Bone Turnover by Sex Steroids.” Journal of Cellular Physiology 2010, Volume 224, Issue 2, pages 305–310.
- Sundeep Khosla. “Estrogen and bone: Insights from estrogen-resistant, aromatase deficient, and normal men” Bone. 2008 September ; 43(3): 414–417.
- A.W.C.Kung. “Androgen and bone mass in men.” Asian J Androl 2003 Jun; 5:148-154.
- Filip Callewaert, Steven Boonen et al., “Sex steroids and the male skeleton: a tale of two hormones.” Trends in Endocrinology and Metabolism, 2010 Feb;21(2):89-95.
- Juan Balasch. “Sex steroids and bone: current perspectives”, Human Reproduction Update, Vol.9, No.3 pp. 207–222, 2003.
- R. Lala, A. Piga et al., Journ of Pediatr Endocrinol and Metabol, 1998, vol. 11, suppl.3, pp.785–790.
- F.R.Pérez-López, P.Chedraui et al., “Bone mass gain during puberty and adolescence: Deconstructing gender characteristics.” Current Medicinal Chemistry, 2010;17(5):453-66.
- Subburaman Mohan, Charmaine Richman et al., “Insulin-Like Growth Factor regulates peak bone mineral density in mice by both Growth Hormone-dependent and -independent mechanisms.” Endocrinology 2003 144: 929-936.
- J.P.Bonjour, T.Chevalley et al., “The importance and relevance of peak bone mass in the prevalence of osteoporosis.” J Salud Publica Mex. 2009; 51 Suppl 1:S5-17.
- S.Perrini, L.Laviola et al., “The GH/IGF1 axis and signaling pathways in the muscle and bone mechanisms underlying age-related skeletal muscle wasting and osteoporosis.” Journal of Endocrinology (2010) 205, 201–210.
- Mary Russell-Aulet, Brahm Shapiro et al., “Peak Bone Mass in young healthy men is correlated with the Magnitude of endogenous Growth Hormone secretion.”
J. Clin. Endocrinol. Metab. 1998 83: 3463-3468.
- AT.Soliman, N.El.Banna et al., “GH response to provocation and circulating IGF-I and IGF-binding protein-3 concentrations, the IGF-I generation test and clinical response to GH therapy in children with beta-thalassaemia.” Eur J Endocrinol April 1, 1998, 138, (4) 394-400.
- Karamifar H, De Sanctis V. et al., “Reduced insulin growth factor I concentrations in iron-overloaded beta thalassaemic patients with normal growth hormone secretion and liver function.” Pediatr Endocrinol Rev 2004; 2 (Suppl 2):256-8.
- V. De Sanctis. “Growth and puberty and its management in thalassaemia,” Hormone Research, vol. 58, supplement 1, pp. 72–79, 2002.
- Italian Working Group on Endocrine Complications in Non-Endocrine Diseases. (1995) “Multicentre study on prevalence of endocrine complications in thalassaemia major.” Clinical Endocrinology (Oct), 42, 581-586.
- Monge L., Pinach S. et al (2001) “The possible role of autoimmunity in the pathogenesis diabetes in b-thalassemia major.” Diabetes & Metabolism 2001 Apr;27(2 Pt 1):149-54.
- Δ. Θ. Καραμήτσος, “Διαβητολογία” 2009, 2η Έκδοση.
- S.De Virgiliis, M.Congia et al., “Deferoxamine-induced growth retardation in patients with thalassemia major.” Journal of Pediatrics, vol.113, no.4, 1988, pp. 661–669.
- A.Moulas, A.Challa et al., “Vitamin D metabolites (25-hydroxyvitamin D, 24,25-dihydroxyvitamin D and 1,25-dihydroxyvitamin D) and osteocalcin in β-thalassaemia,” Acta Paediatrica, vol. 86, no. 6, 1997, pp. 594–599.
- Wonke B., Jensen C. et al. “Genetic and acquired predisposing factors and treatment of osteoporosis in thalassaemia major.” J. Pediatr. Endocrinol. Metab. 1998. 11(Suppl.3): 795–801.
- Dresner Pollack R., Rachmilewitz E. et al., “Bone mineral metabolism in adults with beta-thalassemia major and intermedia.” Br J Hematol 2000; 111: 902-907.
- Skordis N., Efstathiou E. et al., “Hormonal dysregulation and bones in thalassaemia – an overview.” Pediatr Endocrinol Rev. 2008 Oct;6 Suppl 1:107-15.
- Elliot P.Vichinsky. “The morbidity of bone disease in Thalassemia.” Annals New York Academy of Science, 1998, Jun 30;850: 344-8.
- Borgna-Pignatti C, Cappellini MD et al., “Survival and complications in thalassemia.”
Ann N Y Acad Sci. 2005;1054:40-7.
- P.E.S.Palmer, M.M.Reeder. “The Imaging of Tropical Diseases: With Epidemiological, Pathological and Clinical Correlation.”, 2nd Edition, 2001, British Institute of Radiology –
- Tyler PA, Madani G. et al., “The radiological appearances of Thalassemia.” Clinical Radiology 2006; 61(1):40-52.
- Φερτάκης Αρ., “Παθολογική Φυσιολογία Ιατρικού Τμήματος Πανεπιστημίου Αθηνών.” Ιατρικές Εκδόσεις Π.Χ.Πασχαλίδης, Αθήνα 1998, Τόμος Β’, σελ.406-409.
-
IOF/International Society for Clinical Densitometry (ISCD) 2007 & 2010.
-
E.B.Fung, E.P.Vichinsky et al. “Characterization of Low Bone Mass in Young Patients with Thalassemia by DXA, pQCT and Markers of Bone Turnover.” Bone. 2011 June 1; 48(6): 1305–1312.
-
Ladis V., Gandaifis N. et al., “Bone density study at the distal radius, using pQCT analysis in Greek thalassemic patients.” Pediatr Endocrinol Rev. 2004;2(Suppl2):307–9.
-
Shamshirsaz AA, Bekheirnia MR. et al., “Bone mineral density in Iranian adolescents and young adults with thalassemia major.” Pediatric Hematology and Oncology. 2007;24 (7):469–479.
-
C.J.Rosen, J.E.Compston, L.B.Lian. “Primer on the Metabolic Bone Diseases and Disorders of Mineral Metabolism”, 7th Edition, 2008, ASBMR.
- P.Nielsen, R.Engelhardt et al., “Italian Society of Hematology guidelines for thalassemia and non-invasive iron measurements”. Haematologica, 2009 February; 94(2): 294–295.
- United Kingdom Thalassemia Society. “Standards for the clinical care of children and adults with thalassaemia in the UK.” 2008.
- Napoli N., Carmina E., “Low serum levels of 25-hydroxy vitamin D in adults affected by thalassemia major or intermedia.” Bone 2006; 38(6):888-892.
- Morabito N., Lasco A. et al. “Bisphosphonates in the treatment of thalassemia-induced osteoporosis. Osteoporos Int 2002;13:644-9.
- Pennisi P., Pizzarelli G. et al., “Quantitative ultrasound of bone and clodronate effects in thalassemia-induced osteoporosis.” J Bone Miner Metab 2003;21:402–8
- Voskaridou E., Terpos E. et al., “Pamidronate is an effective treatment for osteoporosis in patients with β-thalassaemia.” Br J Haematol 2003, 123:730–7.
- Voskaridou E., Anagnostopoulos A. et al, “Zoledronic acid for the treatment of osteoporosis in patients with β-thalassemia: results from a single-center, randomized, placebo-controlled trial.” Haematologica 2006, 91:1193–202.
- Viereck V., Emons G. et al., “Bisphosphonates pamidronate and zoledronic acid stimulate osteoprotegerin production by primary human osteoblasts.” Biochem Biophys Res Commun 2002; 291: 680–6.
-
Pan B., Farrugia AN. et al., “The nitrogencontaining bisphosphonate, zoledronic acid, influences RANKL expression in human osteoblast-like cells by activating TNF-alpha converting enzyme (TACE). J Bone Miner Res 2004;19:147–54.
-
V.Perifanis, T.Vyzantiadis et al. “Treatment of beta-thalassaemia-associated osteoporosis with zoledronic acid.” British Journal of Haematology April 2004, Volume 125, Issue 1, pages 91–92.
-
E. Carmina, G.Di Fede et al, “Hypogonadism and Hormone Replacement Therapy on Bone Mass of Adult Women with Thalassemia Major.” Calcified Tissue International January 2004, Volume 74, Issue 1, pp 68-71.
-
A. Lasco, N. Morabito et al., “Effects of Hormonal Replacement Therapy on Bone Metabolism in Young Adults with Beta-thalassemia Major.” Osteoporosis International
August 2001, Volume 12, Issue 7, pp 570-575.
-
M.L.G. Anapllotou, I.T. Kastanias et al., “The contribution of hypogonadism to the development of osteoporosis in thalassaemia major: new therapeutic approaches.”
Clinical Endocrinology, Volume 42, Issue 3, pages 279–287, March 1995
-
European Medicines Agency, 2010.
-
M.Yassin, A.f.T Soliman, V.De Sanctis et al., “Effects of Anti RANK ligand Denosumab on Beta Thalassemia induced osteoporosis”. Haematologica Jun 2013; 98(Suppl.#1):168